Puede que la aprobación de las vacunas COVID-19 se haya acelerado, pero estos medicamentos siguen estando sujetos a rigurosos controles por parte de las autoridades reguladoras.
Una oleada de mensajes en redes sociales ha malinterpretado una reciente declaración de la Comisión Europea, presentándola de forma errónea como si Bruselas hubiera admitido que las vacunas contra la COVID-19 se aprobaron sin los controles necesarios.
 PUBLICIDAD
PUBLICIDAD
 PUBLICIDAD
PUBLICIDAD
"Desde 2020 nos aseguraron que todo era seguro, que las vacunas habían sido probadas a fondo. Ahora la señora Von der Leyen y sus tecnócratas de Bruselas reconocen que las autorizaciones se concedieron con un expediente incompleto", afirmó un creador de contenido conocido como 'CharOfficiel' en un vídeo difundido en YouTube, que supera las 16.000 visualizaciones.
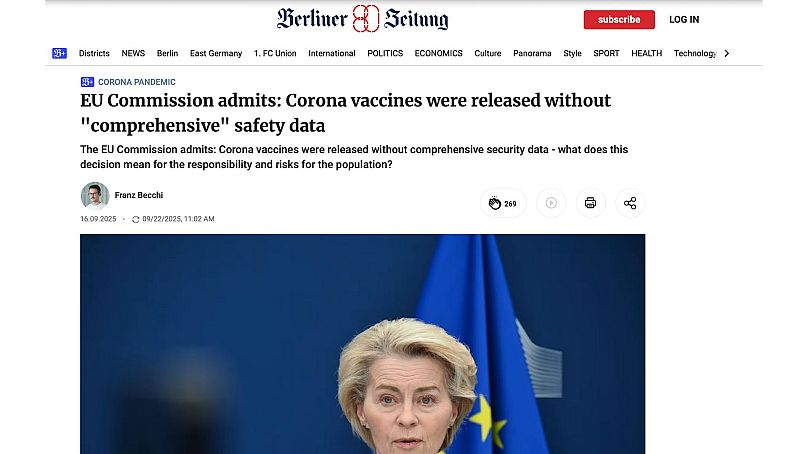
El usuario respalda su acusación citando un artículo publicado el 16 de septiembre de 2025 por el diario alemán 'Berliner Zeitung', titulado: "La Comisión de la UE admite: las vacunas contra el coronavirus se aprobaron sin datos de seguridad 'exhaustivos'".
En su artículo, el 'Berliner Zeitung' afirma que "la Comisión de la UE ha admitido que las vacunas contra el coronavirus se administraron a la población sin datos de seguridad suficientes".
El diario hace referencia a una pregunta parlamentaria presentada a la Comisión Europea por Gerald Hauser, eurodiputado austriaco del grupo de extrema derecha Patriotas por Europa (PfE) y conocido por su oposición a la estrategia europea de vacunación.
En una serie de preguntas centradas en la vacuna Comirnaty COVID-19 —desarrollada por las farmacéuticas BioNTech y Pfizer, y la primera en ser aprobada en Europa—, Hauser planteó: "¿Por qué la Comisión no respetó el Tratado e informó a los ciudadanos, tal como se establecía en el contrato, de que la eficacia y la seguridad de la vacuna basada en genes no estaban garantizadas?".
Datos malinterpretados
En agosto, la Comisión respondió que estas vacunas recibieron una "autorización de comercialización condicional", una figura legal que permite aprobar medicamentos destinados a cubrir necesidades médicas urgentes, aunque el expediente de datos aún no esté completamente finalizado.
El 'Berliner Zeitung' explicó a Euroverify que empleó comillas alrededor de la palabra "exhaustivo" en su titular "precisamente para indicar que la frase se extrae de la propia declaración de la Comisión".
Otro medio, el 'European Conservative', también publicó una pieza sobre la respuesta de Bruselas, titulada: "Las vacunas COVID-19 se aprobaron sin los debidos procedimientos de control sanitario, admite la Comisión de la UE".
En su artículo, el 'European Conservative' fue más allá y acusó a la Comisión de haber ocultado "información esencial en el mismo momento en que se pedía a los ciudadanos un acto de confianza masiva".
En realidad, la respuesta de la Comisión Europea no constituye ninguna nueva "admisión", ya que desde hace tiempo es de dominio público que la aprobación de las vacunas contra la COVID-19 se aceleró ante la emergencia sanitaria provocada por la pandemia.
Un portavoz de la Comisión explicó a Euroverify que la respuesta enviada al eurodiputado Hauser ha sido malinterpretada, y aclaró que las autorizaciones de comercialización condicional permiten aprobar medicamentos cuando existen "datos clínicos menos completos de lo que normalmente se requiere", siempre que haya una necesidad médica urgente.
Autorización condicional, no aprobación sin control
Este tipo de autorización es una herramienta regulatoria prevista para situaciones de emergencia sanitaria, cuando la urgencia de disponer de una vacuna o tratamiento supera los riesgos derivados de no contar aún con todos los datos disponibles.
Las vacunas contra la COVID-19 siguieron ese mismo procedimiento. No fueron una excepción: la vacuna contra el ébola recibió también una autorización condicional en 2019, durante la epidemia, y obtuvo su aprobación completa dos años después, en 2021.
"En interés de la salud pública, se puede conceder a los solicitantes una autorización de comercialización condicional sobre la base de datos clínicos menos completos de lo habitual, cuando el beneficio de la disponibilidad inmediata del medicamento supera el riesgo inherente a la falta de datos adicionales", señaló un portavoz de la Comisión a 'Euronews'.
El portavoz añadió que "todas las obligaciones se han cumplido desde entonces y las vacunas contra la COVID-19 cuentan ya con autorizaciones de comercialización plenas".
Aunque en un principio las vacunas se aprobaron bajo un régimen condicional, no se omitieron las pruebas clínicas. Miles de personas participaron en ensayos controlados, cuyas evaluaciones fueron revisadas por la Agencia Europea de Medicamentos (EMA) antes de la aprobación inicial.
Una vez obtenidas las autorizaciones plenas, la EMA y los Estados miembros de la UE continúan supervisando los informes de posibles efectos adversos, lo que significa que las autorizaciones pueden modificarse o retirarse si se detectan nuevos riesgos.
De acuerdo con un estudio publicado en la revista científica 'The Lancet Respiratory Medicine', las vacunas contra la COVID-19 redujeron la mortalidad en un 59% entre diciembre de 2020 y marzo de 2023, lo que equivale a alrededor de 1,6 millones de vidas salvadas en Europa.